Chemie – PSE und chemische Bindungen Supporting tagline
Überblick
PSE

Chemische Bindungen
PSE – Periodensystem der Elemente
Welche Informationen enthält das PSE?

- Ordnungszahl (aka. Kernladungszahl)
- Anzahl Elektronen/Protonen des Elements.
- Symbol
- Abkürzung eines Elements.
- Hauptgruppen
- Gruppiert Atome mit gleicher Anzahl Elektronen auf Außenschale.
Gruppiert Atome mit ähnlichen Eigenschaften.
Enthalten die wichtigsten Atome.
- Nebengruppen
- Gruppiert Atome mit ähnlichen Eigenschaften.
- Perioden
- Gruppiert Atome mit der gleichen Anzahl Elektronenschalen.
Sortierung
Pro Periode sind Elemente nach ihrer EN von links beginnend aufsteigend sortiert; von oben absteigend innerhalb einer Elementgruppe.
Chemische Bindungen
Um die Edelgaskonfiguration zu erreichen, gehen Atome chemischen Bindungen ein.
Welche Bindungen gibt es?
-
Atombindung – bestehend aus Nichtmetallatomen
-
Ionenbindung – bestehend aus Nichtmetall- und Metallatom
-
Metallbindung – bestehend aus Metallatomen
Wichtige Begriffe
- Elektronegativität (EN)
- Die Höhe der EN ist ein relatives Maß für die Fähigkeit eines Atoms,
Elektronen eines anderen Atoms anzuziehen.
- Ein hoher Wert eines Atoms führt dazu, dass es Elektronen anzieht.
- Ein niedriger Wert eines Atoms führt dazu, dass es Elektronen abgibt.
Die EN beeinflusst außerdem den Ionenbindungscharakter.
Der Wert ist abhängig von der Kernladung und dem Atomradius des Atoms.
Atombindung
Elektronen gehen nicht von einem Atom zum anderen über, sondern werden zwischen den Atomen geteilt. Mal sind die Elektronen bei Atom A, dann bei Atom B und mal zwischen beiden Atomen.

Voraussetzungen
-
Atomen des selben Elements
-
oder Atomen verschiedener Elemente wenn ihre EN gering oder gleich null ist.
Ergebnis
- Moleküle sind nicht geladen.
Eigenschaften
- flüchtig
- makromolekular
- diamentenartig
Ionenbindung
In einer Ionenbindung werden Elektronen von einem zum anderen Atom übergeben.
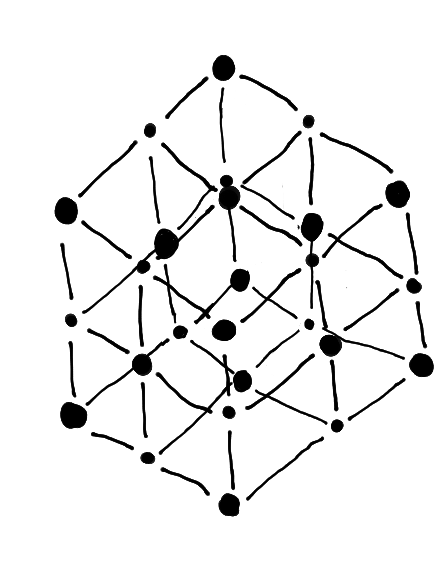
Voraussetzungen
- Atomen verschiedener Elemente mit sehr hoher EN.
Ergebnis
- Positve und negativ geladene Ionen.
Eigenschaften
- hohe Schmelz- und Siedepunkte
- hard, zerspringt häufig bei dem Versuch ihn zu verformen
- Ionenbindungscharakter
- Beschreibt, ob sich Elemente in einer Ionenverbindung verbinden.
Errechnet sich aus der Differenz der EN zwischen den gebunden Elementen.
Metallbindung
Atome werden zu positiven Ionen, die ein Gitter um die negativ geladenen Elektronen bilden (Elektronengas).

- Legierung
- Stoff bestehend aus mind. 2 unterschiedlichen Metallen. Kann auch Nichtmetalle enthalten.
Eigenschaften von Metallverbindungen
- elektr. Leitfähigkeit
- Wärmeleitfähigkeit
- mechanische Verformbarkeit
- metallischer Glanz
Anmerkung
Je leichter beweglich Elektronen sind,
-
desto höher ist die Leitfähigkeit von Metallen
-
desto niedriger ist ihr Widerstand.
Beispiele für chemische Verbindungen
Wichtige Begriffe
- Dipol
- Teilchen, dass zwei entgegengesetzte elektrisch geladene Seiten hat.
- Dipolmolekül
- Molekül, dass zwei entgegengesetzte elektrisch geladene Seiten hat.
Lösungsvorgang von Kochsalz in Wasser
Kochsalz
Kochsalz besteht aus der chemischen Verbindung NaCl (Natriumchlorid).
NaCl ist eine Ionenverbindung aus positiv geladenen Metallionen und negativ geladenen Nichtmetallionen.
Wasser
Wasser besteht aus der chemischen Verbindung H₂O, das ein Dipolmolekül ist. Es hat die Fähigkeit Stoffe auflösen zu können.
Lösungsvorgang
Zusammengefasst erfolgt der Lösungsvorgang von NaCl in H₂O wie folgt:
NaCl besteht besteht aus Ionen, die in einem Ionengitter angeordnet sind; H₂O ist ein Dipolmolekül.
-
NaCl wird in Wasser (H₂O) gegeben.
-
Die Dipolmoleküle von H₂O ziehen die Ionen von NaCl aus ihrem Ionengitter heraus.
-
Es entstehen folgende Ionen.

Wiederholung
- Molekül
- An einer chemischen Verbindung beteiligte Atome.
blog comments powered by Disqus