Wärmelehre Supporting tagline
Überblick
Im folgenden wird das Thema Wärmelehre behandelt. Neben den Formeln wird auf folgende Inhalte näher eingegangen:
- Wie verhälten sich Stoffe wenn sie erwärmt werden?
- Was ist Wärme und Energie?
- Was ist Wärmemenge?
- Was ist Wärmekapazität?
- Schmelztemparturen
- Aggregatzustandsänderung
Allgemein
Für alle Formeln gilt:
Temperatur
- Siedepunkt
- Temperatur unter der das Wasser siedet.
- Fundamentalpunkt
- Zwei Temparaturen die ohne Thermometer wiederhergestellt werden können: Gefrierpunkt und Siedepunkt des Wassers.
- Fundamentalabstand
- Abstand zwischen den einzelnen Fundamentalpunkten.
| °C | 0 °C / 100 °C |
| K | 273,15 K / 373,15 K |
| °F | 32 °F / 212 °F |
°C in K umrechnen:
K in °C umrechnen:
Wie reagieren Stoffe auf Wärme?
- Wärmeausdehnung
- Regel: Volumen nimmt durch erwärmen zu.
Es werden unterschieden:
- das Volumen von festen Körpern – insbesondere die Länge
- das Volumen von Flüssigkeiten
- das Volumen von Gasen
Längen von festen Körpern
- Linearer Ausdehnungskoeffizient α
- Der Wert um den sich ein Stoff nach dem Erwärmen von 0 °C auf 1 °C ausdehnt. Der Ausdehnungskoeffizient ist eine Materialkonstante, jeder Stoff hat einen eigenen Wert.
Längenänderung nach Temparaturerhöhung:
Neue Länge nach Temparaturänderung von ϑ:
Länge für Anfangstemparatur ϑ ≠ 0:
Volumen von festen Körpern
Ausdehnungskoeffizient:
Volumenänderung nach Temparaturerhöhung von ϑ:
Neues Volumen nach Temperaturerhöhung von ϑ:
Volumen für Anfangstemparatur ϑ ≠ 0:
Volumen von Flüssigkeiten
Die Formeln für feste Körper können auch für Flüssigkeiten angewendet werden. Flüssigkeiten in z.B. Liter sind in cm³ umzurechnen.
Dichte von Flüssigkeiten:
Volumen von Gasen
Unabhängig der Gase wird der gleiche Ausdehnungskoeffizient verwendet:
Volumenänderung nach Temperaturänderung von ϑ:
Neues Volumen nach Temperaturänderung von ϑ:
Energie
- Energie
- Die physikalische Größe der beiden Erscheinungsformen Wärmemenge und mechanische Arbeit.
Energie und deren Erscheinungsformen werden in der J (Joule) gemessen.
Wärmemenge
Es ist immer dieselbe Wassermenge notwendig um 1 g Wasser um 1 °C zu erwärmen. Die benötigte Wassermenge ist proportional zu dem Produkt aus Wassermenge und Temperaturdifferenz:
- Proportionalität
- Zwei variable Größen die immer im gleichen Verhältnis zueinander stehen. Siehe Wikipedia
- Meschanische Arbeit
- Erscheinungsform von Energie.
- Wärmemenge Q
- Erscheinungsform von Energie.
- Spezifische Wärmekapazität c
- Benötigte Wärmemenge in Joule um 1 g eines Stoffes um 1 K zu erwärmen.
c ist eine Materialkonstante
Anmerkung:
mechanische Arbeit kann umgewandelt werden in Wärmemenge
Wärmemenge kann mechanische Arbeit leisten
Mischungstemperaturen
Stoffe können vermischt werden; die Temperatur der Mischung ist wie folgt zu berechnen:
Besteht die Mischung hingegen aus den gleichen Stoffen, kann c gekürzt werden:
Aggregatzustandsänderung
- Schmelzen und Verdampfen benötigen Energie und nehmen daher Wärme auf,
- Erstarren und Kondensieren geben diese hingegen wieder frei.
Schmelzen und Erstarren
- Erstarrungstempartur
- Identisch zu Schmelztemperatur.
Verunreinigungen reduzieren die Erstarrungstemparatur.
- Schmelztemperatur
- Identisch zu Erstarrungstempartur.
- Spezifische Schmelzwärme
- Wärmemenge die benötigt wird um 1 g eines Stoffes zu schmelzen.
Die Temparatur ändert sich nicht während des Schmelzens oder Erstarrens.
- Für das Schmelzen wird die Wärmemenge für die Zustandsänderung benötigt.
- Während des Erstarrens wird hingegen Wärme frei.
Regel: Stoffe ziehen sich beim Erstarren zusammen.
Außnahmen, u.a.:
- Wasser
- Quecksilber
Wasser dehnt sich bereits < 4 °C aus – max. 10 %.
Ursache ist hierfür, dass sich die Teilchen von Wasser zu einem Kristallgitter zusammenziehen.
Lösungsmittel
Auch Lösungsmittel können verwendet werden um Stoffe von einer festen Form in eine flüssige umzuwandeln.
Regel: Während des Lösungsvorgangs entziehen feste Stoffe den Flüssigkeiten Lösungswärme.
- Lösungsmittel
- Die Flüssigkeit die für Lösungsvorgang verwendet wird.
- Lösungsvorgang
- Der Übergang von fester in flüssiger Form per Lösungsmittel.
- Lösungswärme
- Wärmemenge die verbraucht wird während des Lösungsvorgangs.
Verdampfen und Kondensieren
- Verdunstung
- Die Flüssigkeit an der Oberfläche wird ständig verdampft.
- Verdampfung
- Vorgang bei dem eine Flüssigkeit in Dampf umgewandelt wird.
- Kondensierung
- Gegenteil von Verdampfung: Vorgang bei dem Dampf in Flüssigkeit umgewendet wird.
- Sieden
- Verdampfung des Stoffes setzt durch das Erreichen der Siedetemperatur ein.
- Siedetemperatur
- Temperatur bei der Stoffe sieden. Stoffe haben unterschiedliche Siedetemperaturen, die vom Druck abhängen. Die Temperatur ist erreicht, wenn der Dampfdruck einer Flüssigkeit größer ist als der Außendruck.
- Spezifische Verdampfungswärme σ
- Wärmemenge die benötigt wird um 1 g einer Flüssigkeit zu verdampfen.
- Spezifische Kondensationswärme Q
- Wärmemenge die frei wird wenn 1 g Dampf kondensiert.
Wärmemenge die beim Sieden verbraucht wurde, entspricht der freigewordenen Wärmemenge beim Kondensieren.
Spezifische Verdampfungswärme = Spezifische Kondensationswärme.
- Verdunstungsvorgang
-
- Flüssigkeiten kühlen sich ab.
- Abhängig von Feuchtigkeitsgehalt in der Luft.
Druck
Wie bereits angemerkt, ist die Siedetempartur abhängig vom Druck. Es folgt eine Definition von Druck.
- Druck
- Druck wird durch eine Kraft, die auf eine Fläche einwirkt, verurscht: Quotient von Kraft durch Fläche.
Einheit: 1 Pa (Pascal)
- Kraft
- Einheit: 1 N
- Fläche
- Einheit: m²
Teilchen
Wärme ist eine Erscheinungsform der Energie und verändert den Zustand eines Stoffes. Stoffe bestehen aus Atomen oder Molekühlen die sich ständig bewegen:
Bei festen Stoffen bewegen sie sich an einem festen Platz.
Bei Flüssigkeiten bewegen sie sich in der gesamten Flüssigkeit.
Bei Gasen bewegen sie sich in dem Raum, der dem Gas zur Verfügung steht.
Durch Wärme erhöht sich die Geschwindigkeit der Teilchen – bei abnehmender Wärme reduziert sich das Volumen und die Geschwindigkeit der Teilchen und sie bekommen einen festen Platz.
Zusammenfassung
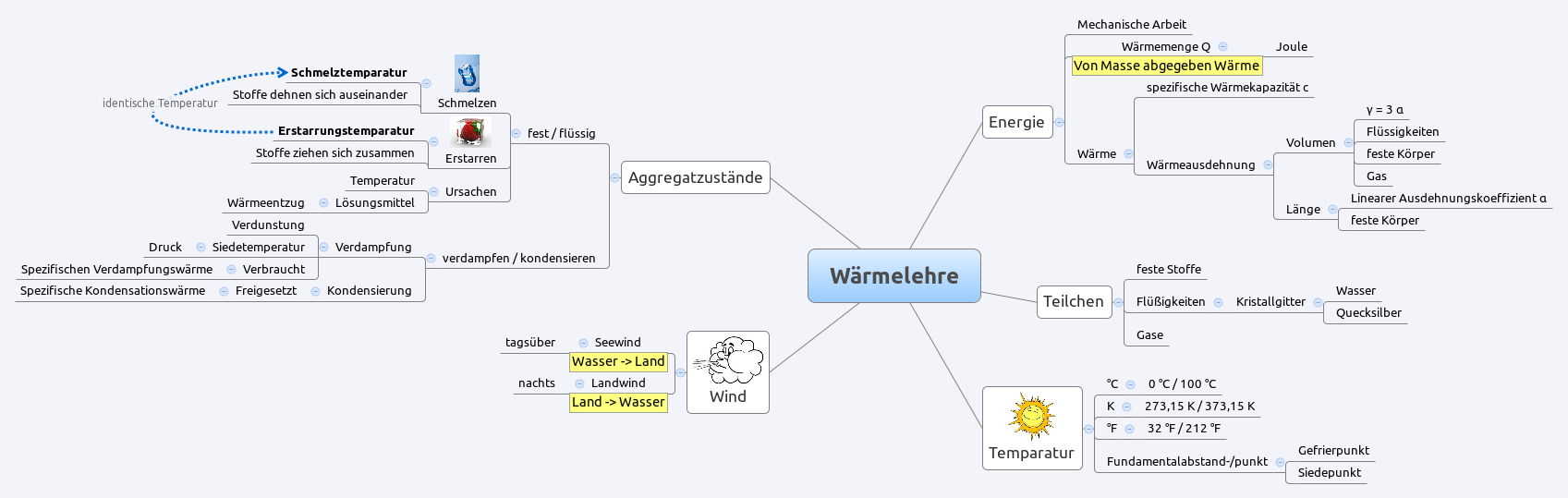
Die Mindmap gibt eine Überblick über die wichtigsten Punkte der Währmelehre.
blog comments powered by Disqus