Aufbau der Atome Supporting tagline
Überblick
Im folgenden wird beschrieben wie Atome aufgebaut sind, sich ihre Teilchen bewegen und was sind Reaktionsgleichungen sind.
Atommodelle
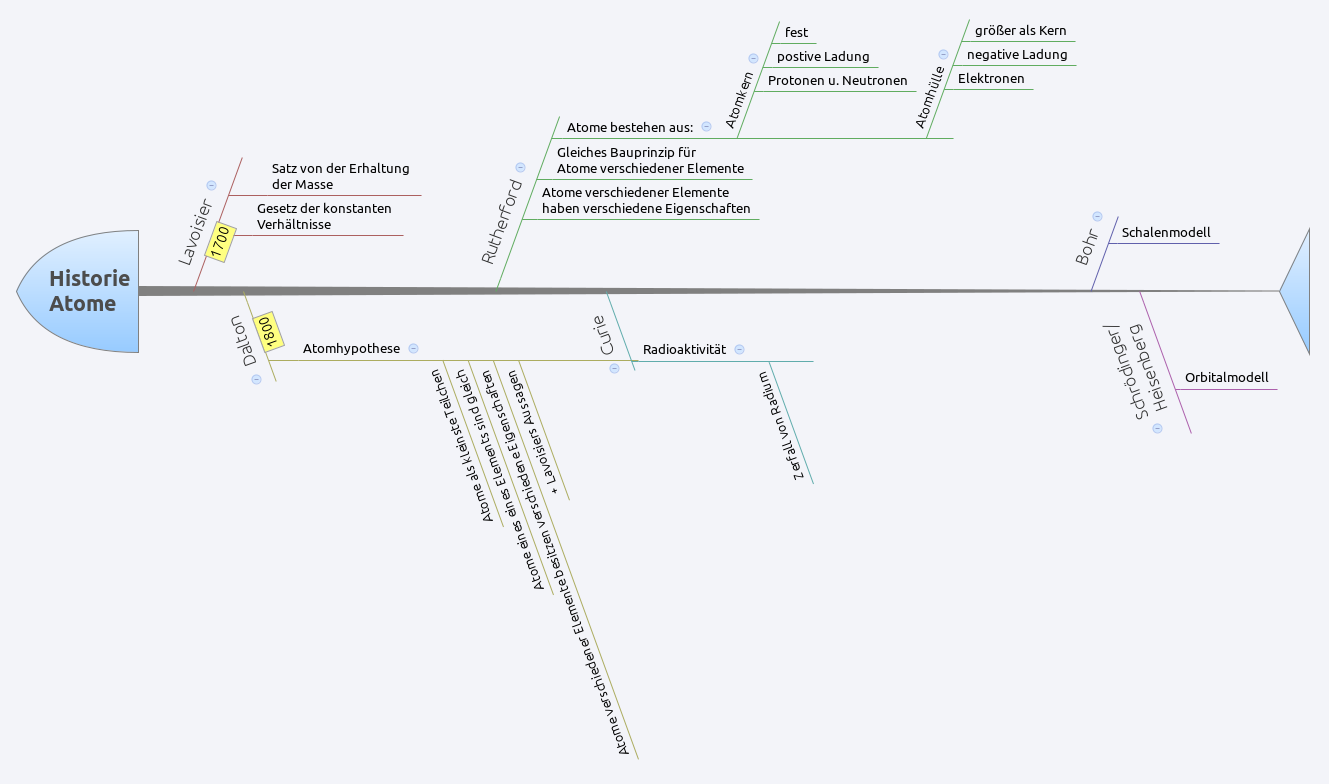
Historie
Eine Übersicht über den historischen Verlauf der Entdeckung der Atome:
- Atom
- Nach Daltons Atomhypothese noch als kleinste unteilbare Teilchen definiert, änderte sich diese Vorstellung mit späteren Atommodellen.
Voraussetzungen für Rutherfords Experiment
Lavoisier
Satz von der Erhaltung der Masse
Nichts wird erschaffen, in jeder neuen chemische Verbindung wird die gleiche Menge Materie wiederverwendet.
Satz von den konstanten Proportionen
Verbindungen besitzen konstante Zusammensetzungen, daher verbinden sich Elemente in konstanten Verhältnissen.
Ehepaar Curie
Das Ehepaar Curie erforschte den Zerfall von Radium. Bei dessen Zerfall das Element Blei unter radioaktiver Strahlung entseht.
Diese führte zu Vermutungen nach denen Atome teilbar sind und alle Elemente dach dem gleichen Prinzip aufgebaut sind.
Diese Vorstellungen bewies Rutherford mit einem wichtigen Experiment.
- Ladung
- Elektrizität/elektrische Ladung ist eine Stoffeigenschaften in zwei Arten: Positive und negative Ladung. Körper mit gleicher Ladung stoßen sich ab – unterschiedliche Ladungen ziehen sich an.
- Coulombsches Gesetz
- elektrisches Feld
- Ein Feld das elektrisch geladene Körper umfasst, das die Kraftwirkung auf eine weitere Ladung vermittelt.
Strahlungsarten
- Radioaktivität
- Aus Experimenten mit Magnetfeldern konnte geschlossen werden, dass 3 unterschiedliche Strahlungen existieren.
| α-Strahlen | positiv geladen | |
| ϐ-Strahlen | negativ geladen | Elektronen |
| γ-Strahlen | elektrisch ungeladen | “Licht”-Energie |
Strahlungen sind zunächst unsichtbar, durch verschiedene Verfahren können sie aber sichtbar gemacht werden.
- Halbwertszeit
- Zeit in der die Hälfte von Atomen eines radioaktiven Elements zerfallen sind.
Rutherfords Experiment
Atommodell nach Rutherford

Erkenntnisse aus Experiment:
- Atome sind keine festen Kugeln, sondern weitestgehend leer.
- Besitzen positiv geladenen Atomkern.
- Atomhülle besteht aus negativ geladene Elektronen.
- Atom
- Neutral geladen. Besteht aus Atomkern und Atomhülle.
- Atomkern
- Positiv geladen. Bestehend aus Protonen und Neutronen.
- Proton
- Positiv geladen.
- Neutronen
- Neutral geladen. Verhindern das sich die Protonen abstoßen, indem sie sich zwischen die Protonen legen.
- Atomhülle
- Im Vergleich zum Atomkern: leicht, weit und nahezu masselos.
- Elektronen
- Negativ geladen. In der Regel bewegen sie sich auf Kreisbahnen um den Atomkern. Die Elektronenanzahl ist gleich zur Protonenanzahl.
- Element
- Ein Stoff dessen Elemente die gleiche Kernladungszahl besitzen.
Größenverhältnis von Atomkern und -hülle:
Atomkern = Streichholzkopf, Atomhülle = Fersehturm
Was machte das Bohrsche Atommodell notwendig?
Ein neues Atommodel wurde notwendig, da Spektrallinien nicht mit Rutherfords Modell erklärt werden konnten.
Elemente strahlen Farben aus, die sich zwischen den Elementen unterscheiden.
- Spektrum
- Farbverteilung von Elementen.
- Spektrallinie
- Einzelne Farbe eines Spektrums. (Wird in Wellenlängen angegeben)
Bohrsches Atommodell (aka. Schalenmodell)
Elektronen sind auf verschiedene Energieniveus verteilt und können zwischen diesen wechseln.
- Energieniveu
- Energiestufen auf denen sich die Elektronen bewegen. Sie können auch zwischen den Niveus wechseln.
Diese Energieniveus werden als Grundzustand und angeregter Zustand bezeichnet:
- Grundzustand
- Energieärmster Zustand von Elektronen.
- Angeregter Zustand
- Elektronen werden angeregt, indem ihnen Energie zugefügt wird (z.B. durch erwärmen). Dadurch können sie ein höheres Energieniveu besetzen – dieser Zustand ist aber nicht stabil.
Die Energie der Differenz zwischen angeregten Zustand und Grundzustand wird in Strahlung – Spektrallinien – frei. Ein Spektrum ist daher ein Abbild aller möglichen Änderungen in den Energieniveus.
Aufbau
- Schalen
- Die Elektronen verteilen sich auf Schalen – auf der 1. Schale max. 2
Elektronen auf der äußersten max. 8. Ein Atom hat max. 7 Schalen gibt.
Die äußeren Schalen sind außerdem energiereicher als die inneren.
- Valenzelektronen
- Elektronen auf der Außenschale.
Die max. Anzahl an Elektronen die auf einer Schale Platz haben berechnet sich mit folgender Formel:
Orbitalmodell

Erweitert das Schalenmodell um Orbitale.
- Orbitale
- Aka. Elektronenwolken. Das sind Räume, in denen sich die Elektronen mit sehr hoher Wahrscheinlichkeit befinden.
Elemente
Einzelne Elemente werden im Periodensystem wie folgt gelistet:
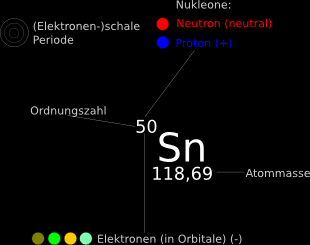
- Kernbausteine
- Protonen und Neutronen.
- Atommasse
- Masse eine Atoms. Diese summiert sich aus der Massse von Protonen und
Neutronen. Elektronen bleiben aufgrund ihrer geringen Masse unberücksichtigt.
Atommasse ≈ Massen der Kernbausteine summiert
- Kernladungszahl
- Anzahl Protonen – Anzahl Neutronen unberücksichtigt, da diese keine Ladung
haben.
Alternativ auch als Ordnungszahl bezeichnet, da Elemente im PSE nach der Kernladungszahl angeordnet sind.
Anzahl der Neutronen = Gerundete Atommasse - Kernladungszahl
Folgende Elemente werden unterschieden
- Atomarten
- Es gibt zwei Atomarten: Isotope und Reinelmente.
- Isotope
- Atomarten deren Protonenanzahl gleich ist, die Neutronenzahl aber unterschiedlich.
- Reinelmente
- Elemente von denen es keine natürlichen Isotope gibt.
Chemische Verbindungen
- Syntehese
- Reaktion von mind. zwei Elementen.
- Moleküle
- Ungeladene Syntehese. Die kleinsten Teile einer chemischen Verbindung.
- Ionen
- Positiv oder negativ geladene Teilchen. Es kann sich um eine Syntehese oder
einzelne Atome handeln.
Ionen entstehen zum Beispiel in chemischen Verbindungen, in denen Atome einen Teil ihrer Elektronen an andere Atome abgeben oder Elektronen von anderen Atomen aufnehmen.
Teilchenbewegung
- Teilchen
- Atome und Moleküle.
in festen Stoffen
- Moleküle sind in regelmäßigen Muster aneinander gepackt.
- Moleküle haben zu wenig Energie um ihre Position zu verändern.
- Arbeit ist notwendig um Kristalle zu deformieren.
in flüssigen Stoffen
- Moleküle sind miteinander in Kontakt – verfügen über außreichend Energie um aneinander vorbeizulgeiten.
- Volumen ist definiert.
- Gestalt ist nicht definiert.
in Gasen
- Moleküle bewegen sich frei durch Raum.
- Nimmt Form des Behälters an.
- Form nicht starr
- kein bestimmtes Volumen
- Komprimiert oder dehnt sich aus.
Rechnerische Analysen
- Chemische Reaktion
- Ausgangstoffe reagieren chemisch miteinander und erzeugen ein Endprodukt.
Mit Reaktionsgleichungen und der Stöchiometrie können Rohstoffkosten, Energiekosten und Ausbeutung ermittelt werden. Außerdem kann damit untersucht werden in welchen Mengen sich die Stoffe verbinden lassen.
Einheiten
- absolute Atommasse
- Die Atommasse in der Einheit: kg.
- relative Atommasse
- Die Atommasse ohne Einheit.
- relative Molekulargewicht
- Die Summe der relativen Atommasse aller an einer chemischen Reaktion beteiligten Atome.
- Mol
- Die im PSE angegebene relative Atommasse in g eines chemischen
Elements. Oder das relative Molekulargewicht einer chemischen Verbindung.
1 Mol eines jeden Gases hat ein Volumen von 22,414 l.
1 Mol hat immer die gleiche Anzahl Atome, die Anzahl entspricht der Avagadro-Konstante.
- Avagadro-Konstante
- Gibt die Anzahl Moleküle oder Atome in 1 Mol eines Stoffes an.
(Einheit mol-1)
Teilweise auch Loschmidt’sche Zahl genannt.
Reaktionsgleichungen
Eine chemische Reaktion kann durch eine Reaktionsgleichung bestimmt werden. Vor dem Aufstellen einer Reaktionsgleichung müssen immer folgende Voraussetzungen erfüllt werden:
- Welche Stoffe reagieren miteinander?
- Aus was setzen sich Reaktionsprodukte zusammen?
- Reaktionsgleichung
- Fasst eine chemische Reaktion inklusive dem Mengenverhältnis kurz zusammen.
Wichtig: Die Summe der Ausgangsstoffe und Endprodukte muss übereinstimmen.
Die Anzahl an Atomen – nicht aber der Anzahl Mol – muss auf beiden Seiten übereinstimmen.
- Chemische Formeln
- Siehe Beispiel.
Stöchiometrie
Auf Grundlage der Reaktionsgleichungen bietet die Stöchiometrie Möglichkeiten die beteiligten Mengen an einer chemischen Reaktion zu berechnen.
- Stöchiometrie
- Analysiert rechnerisch die an einer chemischen Reaktion beteiligten Mengen.
blog comments powered by Disqus